【飞检】7药企GMP证书被收回/被重罚
2016/5/31 药智网


从广西壮族自治区、山西省、广东省、新疆维吾尔自治区等四省(区)药监局和国家食药监总局获悉:3家药企GMP被收回,其中一家同时被责令停产、立案查处,2家药企被吊销《药品经营许可证》,2企业被要求停产整改。
5月30日,广西壮族自治区、山西省、广东省药监局三省(区)分别发布公告,共收回3家药企GMP证书,其中广西金秀圣堂药业涉嫌生产质量管理混乱、伪造批生产等相关记录等违法违规行为,被收回GMP证书,责令停止生产,立案查处。佛山市御嘉中药饮片有限公司在飞检中被查出严重缺陷2项,被收回中药饮片的《药品GMP证书》,同时被责令整改。山西省 山西省药监局日前发布公告,山西维康堂中药饮片有限公司严重违反《药品生产质量管理规范》规定,依据《药品生产质量管理规范认证管理办法》第三十三条规定,该局依法收回其《药品GMP证书》。

广西壮族自治区 5月30日,广西壮族自治区药监局发布公告,广西金秀圣堂药业有限责任公司因严重违反《药品生产质量管理规范》规定,根据《药品生产监督管理办法》第五十五条及《药品生产质量管理规范认证管理办法》第三十三条规定,依法收回其《药品GMP证书》。 企业名称:广西金秀圣堂药业有限责任公司 药品生产许可证编号:桂20160148 涉嫌违法违规行为: 一、生产质量管理混乱 (一)物料领用发放无记录:你公司冷库内存放双山颗粒浸膏已领用但未记录领用情况,且仓管员在检查期间补写一份货位卡提交给执法人员。 (二)生产现场无生产指令:现场正在生产的双山颗粒(批号:20160203)制粒/烘干等工序半成品的物料卡均未记录产品批号;称量间临时被改为制粒操作间;制剂车间现场有双山颗粒(批号:20161201、20160203)成品凌乱堆放在包衣间内或其他生产操作间内;双山颗粒(批号:20150603)浸膏的批生产量与产能不匹配。 (三)生产管理关键岗位人员不在岗:检查时发现,2016年2月24日后你公司关键人员生产部长兼制剂车间主任已离岗,由原来仓管人员庞某负责生产管理,但该员工没有药品生产管理实践经验,不清楚药品生产管理要求。 二、伪造批生产等相关记录 经查实,你公司提供的双山颗粒(批号:20150504)批生产记录、检验记录、成品入库记录均属虚假记录。 处理措施: 广西金秀圣堂药业有限责任公司上述行为已严重违反《药品管理法》及药品GMP相关规定,广西局收回该企业GMP证书,责令企业停止生产,并对发现的违法违规行为依法立案查处。广东省 企业名称:佛山市御嘉中药饮片有限公司 生产地址:佛山市南海区桂城街道平南平顺西路北2号 药品生产许可证编号:粤20160237 事由:有因检查 检查发现的主要问题: 中药饮片(净制、切制、蒸制、炒制、炙制)生产存在严重缺陷2项、其它问题1项,不符合药品GMP要求。有关情况摘要如下: 一、严重缺陷2项。 (一)部分品种无批生产记录,如2016年5月16日至5月19日期间生产的野菊花及苦杏仁等54个品种无批生产记录。 (二)个别品种(如2016年5月14日生产的苦参)未按质量标准进行检验。 二、新增中药饮片生产品种未按要求报所在市食品药品监管局备案,如已备案品种120个,实际在产品种200个。 处理措施: 一、鉴于佛山市御嘉中药饮片有限公司的中药饮片(净制、切制、蒸制、炒制、炙制)生产不符合药品GMP要求。根据药品GMP管理的有关规定,省局决定收回该公司中药饮片(净制、切制、蒸制、炒制、炙制)的《药品GMP证书》(证书编号:GD20150365)。 二、要求佛山市食品药品监管局督促企业整改,加强日常监管及品种备案管理工作。新疆维吾尔自治区
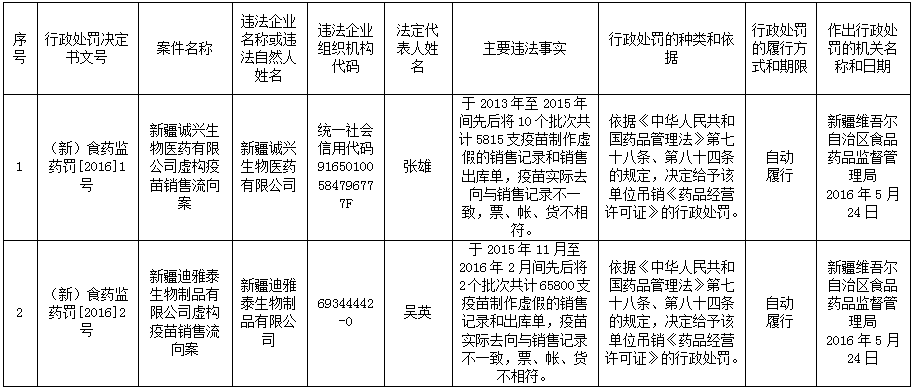
经查,新疆诚兴生物医药有限公司、新疆迪雅泰生物制品有限公司制作虚假的销售记录和销售出库单,疫苗实际去向与销售记录不一致,票、帐、货不相符,情节严重,其行为严重违反《中华人民共和国药品管理法》、《药品经营质量管理规范》有关规定。依据《中华人民共和国药品管理法》第七十八条和第八十四条的规定,经研究决定吊销上述2家企业《药品经营许可证》。
国家食药监局 2016年5月,国家食品药品监督管理总局组织对江苏嘉斯康医疗科技有限公司和山东省文登市整骨科技开发有限公司进行飞行检查。检查中,发现这两家企业质量管理体系严重缺陷,责令召回相关产品,并停产整改。 食药监总局表示待这两家企业完成全部项目整改并经所在地省级食品药品监督管理局跟踪复查合格后方可恢复生产。

申明:本文系药智网整理,欢迎转载,转载请注明出处及链接,谢谢!
新闻来源:药智网
http://www.duyihua.cn
返回 药智网 返回首页 返回百拇医药